Medizin zum Selbermachen Rundbrief
Juli 2022
FAQ:
Unterschied zwischen Chlor, Chlorid, Chlordioxid und Chlorbleiche?!
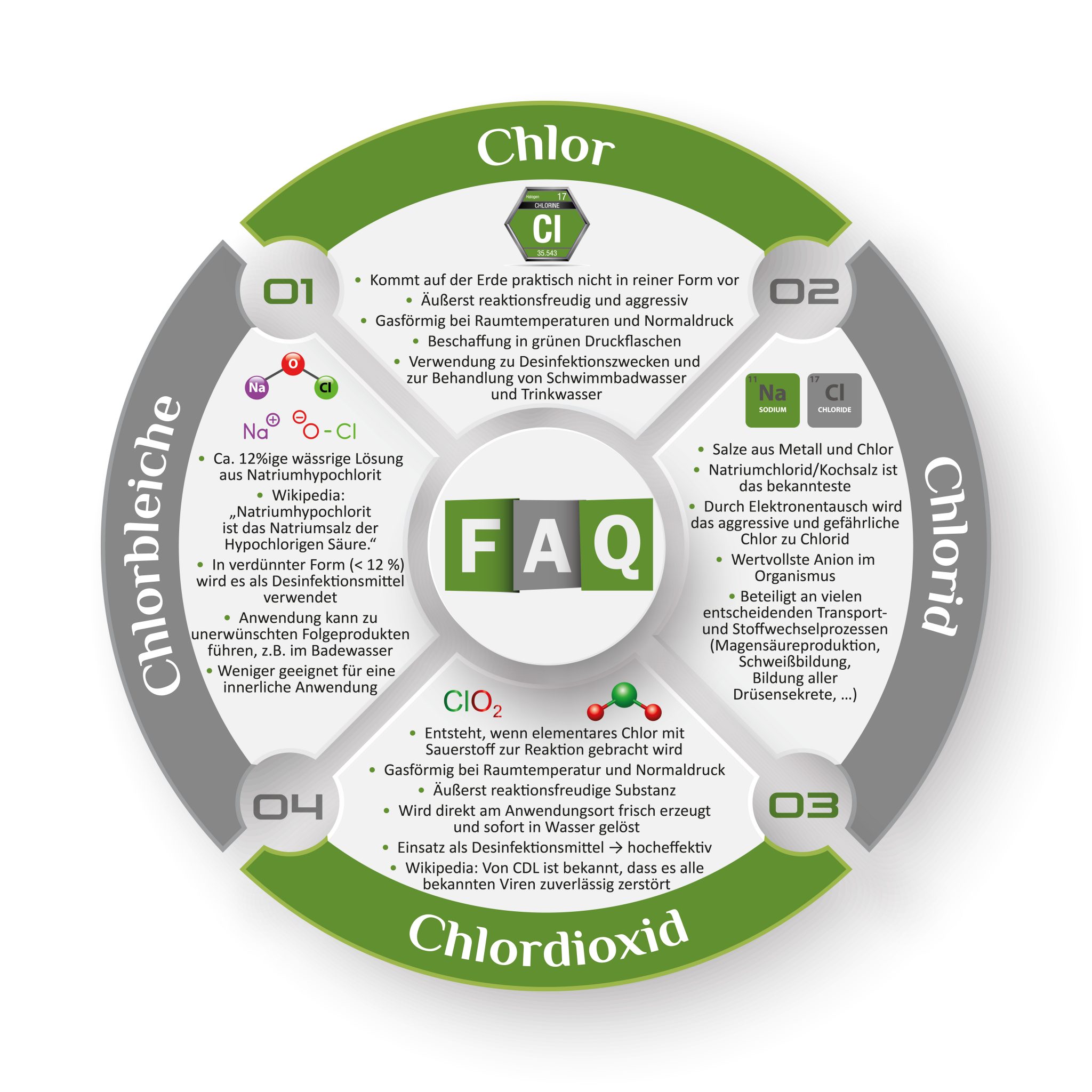
Wir kennen es aus vielen Themenbereichen – Begriffe werden vertauscht, unrichtig verwendet, verallgemeinert, … . Auch und besonders öffentlich-rechtliche Medien, Verlage und andere Institutionen tragen, mit oftmals unexakter Wortwahl und willkürlichen Wortneuschöpfungen, zu Verwirrung und Verunsicherung bei. So fragen viele Menschen nach dem Unterschied zwischen Chlor, Chlorid und Chlordioxid, bzw. können es nicht richtig einschätzen, wenn im Zusammenhang mit CDL oder MMS manipulierend von Chlorbleiche die Rede ist. Es ist jedoch ganz einfach.
Auf den Namen Chlor hört das chemisch reine Element mit der Ordnungszahl 17, in der siebten Hauptgruppe des Periodensystems der Elemente, mit dem Kürzel Cl. Chlor kommt, im Gegensatz zu vielen anderen Elementen des Periodensystems, auf der Erde praktisch nicht in reiner Form vor, da es äußerst reaktionsfreudig ist. Wenn es dennoch in Labor oder Industrie etwa elektrolytisch erzeugt wird, verbinden sich Chloratome sofort untereinander zu Paaren Cl2, die man dann als Chlormoleküle bezeichnet, bestehend aus zwei Chloratomen. Sie teilen sich damit, wie es in der Schule hieß, ein Elektronenpaar und sind dadurch zumindest halbwegs zufrieden, bzw. stabil. Dennoch sind auch diese sog. dimeren Chlormoleküle noch äußerst reaktionsfreudig, um nicht zu sagen aggressiv. Cl2 ist bei Raumtemperaturen und Normaldruck gasförmig, weshalb man Chlor in grünen Druckflaschen kaufen kann. Die Aggressivität von Chlor, bzw. seine diesbezügliche Toxizität gegenüber allen Lebewesen, wird zum Beispiel zu Desinfektionszwecken genutzt. Seine Verwendung zur Behandlung von Schwimmbadwasser und Trinkwasser ist nach wie vor ebenso verbreitet wie verpönt. Die Gefährlichkeit von Chlorgas zeigt sich nicht nur bei immer wieder vorkommenden spektakulären Unfällen, wenn ungewollt solche Druckflaschen havarieren. Obwohl ich schon als Kind mit den vielfältigsten Chemikalien experimentiert habe, einschließlich Zyankali, habe ich niemals so gezittert, wie bei einer Laborsynthese an der Universität, bei der Chlor aus einer Druckflasche dem Reaktionsgemisch zugegeben werden musste.
Zweitens Chlorid: Wenn das elementare Chlor, wie eben beschrieben, mit anderen Elementen reagiert, vornehmlich mit Metallen, dann entstehen Chloride, also Salze aus Metall und Chlor. Das bekannteste dürfte das Natriumchlorid, umgangssprachlich Kochsalz genannt, sein. Die Endung -id zeigt an, wie in der Schule gelernt, dass es sich dann nämlich um Chlor-Ionen handelt. Die Reaktionsfreudigkeit des Chlors führt stets dazu, dass dem jeweiligen nächstgelegenen Reaktionspartner ein Elektron abgeknöpft wird. Diese hohe sogenannte Elektronegativität des Chlors wird nur von einem einzigen anderen Element noch übertroffen, nämlich Fluor.
Im Ergebnis haben wir dann ein einfach negativ geladenes Chlor-Teilchen, weil es sich ein Elektron gestohlen hat und ein einfach positiv geladenes Gegenion, da es ein Elektron heraus rücken musste. Der Reaktionspartner, im Beispiel Kochsalz also das Natriumatom, wird dann zum positiven Natrium-Ion und weißt eine Elektronenlücke auf. Da seine Ladung von 0 auf 1+ steigt, ist hier das Chlor als Oxidationsmittel zu bezeichnen, während es selbst reduziert wird.
Entscheidend für das Leben auf dem Planeten ist nun, dass durch diesen Elektronentausch die beiden Elemente sehr gut wasserlöslich werden und in elektrischen Feldern gemäß ihrer neu gewonnen Ladung wandern können. Ionen die in einem elektrischen Feld zur positiven Seite (Anode) wandern, weil sie negativ geladen sind, nennt man Anionen. Diejenigen die zur negativ geladenen Seite (Kathode) wandern, weil sie positiv geladen sind, nennt man Kationen.
Indem also das eben noch aggressive und gefährliche Chlor durch Elektronentausch zu Chlorid wird, ist es vollkommen gezähmt und darüber hinaus das wertvollste Anion im Organismus. Es kommt am häufigsten vor und ist an vielen entscheidenden Transport- und Stoffwechselprozessen maßgeblich beteiligt, wie zum Beispiel der Magensäureproduktion, der Schweißbildung, der Bildung aller Drüsensekrete etc..
Drittens Chlordioxid: Wird elementares Chlor, welches wir oben kennen gelernt haben, seinerseits oxidiert, also mit Sauerstoff zur Reaktion gebracht, so entsteht Chlordioxid. Ein Molekül aus einem Chloratom und zwei Sauerstoffatomen, ClO2. Chlordioxid ist ebenfalls bei Raumtemperatur und Normaldruck gasförmig.
Da hier zwei stark elektronegative Elemente beteiligt sind, nämlich Sauerstoff und Chlor, ist es auch in dieser Zwangsehe mit der Zufriedenheit nicht so weit her. Sowohl Chlor als auch Sauerstoff möchten die Bindungselektronen gerne für sich beanspruchen, was zu „Sollbruchstellen“ führt, so dass Chlordioxid auch eine äußerst reaktionsfreudige Substanz ist. In reiner Form ist diese sogar explosibel. Aufgrund dieser Reaktionsfreudigkeit kann Chlordioxid auch nicht in Druckflaschen geliefert werden, sondern wird seit jeher direkt am Anwendungsort frisch erzeugt und sofort in Wasser gelöst. Sein größter Vorteil, neben anderen, im Vergleich zum elementaren Chlor: Beim Einsatz als Desinfektionsmittel ist es wesentlich effektiver und es entstehen keine toxischen Reaktionsprodukte, sondern lediglich physiologisch neutrales Chlorid (siehe zweitens). Deshalb gilt es als „Luxusvariante“ bei der Behandlung von Trink- und Badewasser zum Zweck der Desinfektion.
Chlordioxid wird dementsprechend seit Jahrzehnten in Industrie, Versorgung, Medizin und anderen Bereichen vielfältig eingesetzt und beweist immer aufs Neue, was auch ganz lapidar auf Wikipedia zu lesen ist: „Während Chlordioxid gegen Viren, Bakterien, Sporen, Schimmelpilze und sogar Prionen wirksam ist, zeigen einige Typen der sich langsamer vermehrenden Mykobakterien eine hohe Resistenz.“
Mit anderen Worten: Chlordioxid hilft immer, außer bei Lepra und Tuberkulose (Mycobacterium leprae und Mycobacterium tuberculosis).
Witzig: … . und sogar Prionen … . Hihi.
Viertens Chlorbleiche: Definitionsgemäß wird eine ungefähr 12%ige wässrige Lösung aus Natriumhypochlorit als Chlorbleiche bezeichnet. Diese hat also mit allen hier bisher erläuterten Stoffen überhaupt nichts zu tun. Zitat Wikipedia: „Natriumhypochlorit (NaClO) ist das Natriumsalz der Hypochlorigen Säure (HClO, veraltet auch „Unterchlorige Säure“).“
Spätestens an dieser Stelle wird also deutlich, wie man durch unsachgemäße Verwendung von Begrifflichkeiten, schnell von den Tatsachen abgleiten kann und von dem was wir vielleicht als exakte Ausdrucksform bezeichnen wollen. Und auch hier darf die Frage gestellt werden „Wem nützt es?“, wenn allein durch die Wortwahl Zusammenhänge manipulativ verdreht werden.
Nichtsdestotrotz kann auch Hypochlorit medizinisch verwendet werden – es kommt lediglich wieder einmal auf die Konzentration an, also „Die Dosis macht das Gift“. In verdünnter Form, also weit unter 12%, wird auch Natrium- oder Kaliumhypochlorit-Lösung als Desinfektionsmittel verwendet und ist dementsprechend im Handel. Im Fall Natriumhypochlorid ist Chlor, im Gegensatz zum Chlordioxid, lediglich mit einem Sauerstoffatom gekoppelt und dazu kommt noch ein Metallatom, hier Natrium. Auch die Anwendung der Hypochloride kann allerdings zu unerwünschten Folgeprodukten zum Beispiel im Badewasser führen. Für eine innerliche Anwendung wird es deshalb als weniger geeignet eingeschätzt.
